Tutte le molecole sono composte da atomi formati da un nucleo in cui sono presenti protoni e neutroni ed elettroni . Gli elettroni ruotano attorno al nucleo secondo orbite caratterizzate da precisi livelli energetici ed ogni livello energetico ha dei sottolivelli chiamati orbitali in cui possono essere contenuti al massimo 2 elettroni, caratterizzati da un verso di rotazione contrapposto (antiparalleli) chiamato Spin.( principio di esclusione di Pauli)
In tutto questo c’è una certa analogia con i pianeti del sistema solare , per esempio la Terra, che oltre a un moto di rivoluzione intorno al Sole, è animato anche da un moto di rotazione intorno al proprio asse.
Se aumentiamo il numero atomico degli elementi , gli elettroni tendono a distribuirsi sugli orbitali che possiedono lo stesso livello energetico , tutti con lo stesso valore di spin, in questo caso parallelo cioè con lo stesso verso di rotazione, per poi completare gli orbitali rimanenti posizionandosi con spin antiparallelo a quello dell’elettrone già presente . La configurazione a spin paralleli durante il riempimento è una configurazione più stabile che non quella a spin antiparalleli. In un atomo due elettroni che siano inequivocabilmente identici e che occupano lo stesso orbitale devono avere necessariamente spin opposti.
Ossigeno e respirazione
Quando respiriamo l’ossigeno presente nell’aria, passa dai polmoni alla circolazione sanguinea legandosi ad un pigmento chiamato emoglobina. Quando l’emoglobina raggiunge attraverso la circolazione capillare le cellule del nostro organismo, rilascia la molecola di ossigeno e assorbe dalle cellule la Co 2 che si lega ad essa modificando il suo colore da rosso a blu. Una volta assorbito l’ossigeno, il suo utilizzo principale ( 98-99%) è la neutralizzazione di elettroni che provengono dal metabolismo degli alimenti con produzione di energia. Se per esempio mangiamo del pane , lo zucchero che si forma dal processo digestivo , viene trasformato subito in energia dalle nostre cellule sotto forma di elettroni . La molecola dell’ossigeno si combina con questi elettroni all’interno di minuscoli organelli, chiamati mitocondri attraverso un sistema enzimatico altamente specializzato che prende il nome di “catena respiratoria”.Durante questo processo l’ossigeno accetta 4 elettroni provenienti dalla catena respiratoria per produrre due molecole di acqua e tanta energia immagazzinata sotto forma di ATP ( adenosin trifosfato). Senza ATP il nostro organismo non avrebbe l’energia sufficiente per vivere.
Ma, nonostante tutto, circa 1% dell’ossigeno che respiriamo sfugge a questo destino e non viene utilizzato per produrre energia bensì va incontro ad alcuni cambiamenti che lo rendono estremamente nemico e pericoloso per il nostro organismo : la formazione di ROS , specie reattive dell’ossigeno.
L’Ossigeno
Se esaminiamo la struttura elettronica dell’ossigeno molecolare vediamo la presenza nella molecola biatomica di due elettroni non accoppiati posti sul livello energetico più elevato.Se due elettroni si trovano a riempire lo stesso orbitale (atomico o molecolare) si devono disporre a spin antiparalleli come detto nella premessa. Nella molecola biatomica dell’ossigeno, gli ultimi due elettroni sono invece posizionati sugli ultimi 2 orbitali di antilegame a spin paralleli occupando parzialmente entrambi i due orbitali. Quindi l’ossigeno nel suo stato fondamentale, per intenderci l’ossigeno che respiriamo,contiene due elettroni spaiati e sistemati in orbitali diversi. Esso quindi è un diradicale. I due elettroni spaiati avendo spin paralleli formano una barriera all’inserimento di coppie di elettroni nella sua molecola in quanto un orbitale può contenere al massimo due elettroni aventi spin antiparalleli . Questa restrizione di spin rende l’ossigeno molto meno reattivo di quanto ci si aspetterebbe da un punto di vista termodinamico ma può essere superata in vari modi per es. invertendo lo spin di un elettrone dell’ossigeno molecolare con la formazione dello stato attivato dell’ossigeno
R.O.S. : le specie reattive dell’ossigeno
L’ossigeno per via della restrizione di Spin è portato a formare più facilmente radicali liberi piuttosto che legami molecolari per inserimento di un elettrone alla volta . Quando una molecola o atomo accetta un elettrone o un idrogeno , questo processo viene chiamato riduzione. Dall’altra parte quando una molecola o atomo rilascia un elettrone o un idrogeno , il processo prende il nome di ossidazione.
La riduzione univalente dell’ossigeno con l’aggiunta di un elettrone per volta produce R.O.S.
Se una serie di 4 elettroni è addizionata all’ossigeno , si formano 3 R.O.S. con produzione finale di acqua seguendo lo schema:
Oxygen + one electron = Superoxide (02-)
Superoxide + one more electron = Hydrogen peroxide (H20)
Hydrogen peroxide + one more electron = Hydroxyl radical (.OH)
Hydroxyl radical + one more electron + hydrogen = Water (H20)
Solo due delle reazioni di riduzione dell’O2 sono radicali liberi e sono il superossido (Superoxide) e il radicale idrossile (Hydroxyl radical).
Il perossido di idrogeno (Hydrogen peroxide) o acqua ossigenata è un R.O.S. ma non un radicale libero.
Aggiungendo un elettrone per volta all’ossigeno quindi si producono 3 tipi di R.O.S. che sono tutti reattivi e pericolosi. Ma c’è un quarta specie reattiva dell’ossigeno di cui finora non abbiamo accennato , molto pericolosa che si forma principalmente quando ci esponiamo alla luce del sole: l’ossigeno singoletto (simbolo 1O2.)
Un diavoletto eccitato: l’ossigeno singoletto
Quando l’ossigeno è irradiato con luce UV per esempio , assorbe energia a livello molecolare e modifica la sua configurazione. Questo stato è chiamato ossigeno eccitato o singoletto perchè uno degli elettroni spaiati ha elevato il suo stato energetico e invertito il suo numero di spin Ora può comportarsi da ossidante qual’è e attaccare i doppi legami delle molecole organiche presenti negli strati vitali della nostra cute . La pelle , quando esposta ai raggi UV deve costantemente difendersi dai suoi attacchi .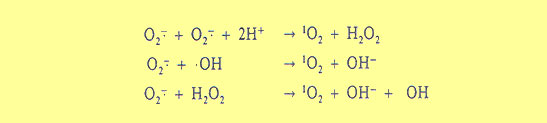
Per ottenere un ossigeno singoletto si deve somministrare energia alla molecola dell’ossigeno atmosferico in modo da invertire lo spin di uno dei 2 elettroni. Nei sistemi biologici, l’ossigeno singoletto può formarsi anche dall’ossigeno ridotto, chiamato anione superossido, per reazione spontanea di ossido-riduzione intermolecolare (dismutazione) oppure per interazione di quest’ultimo con il radicale idrossile o con l’acqua ossigenata ( reazione di Haber-Weiss)
La tossicità del superossido radicale deve quindi anche essere riferita alla possibilità di agire da precursore di ossigeno singoletto.
L’ossigeno singoletto si può anche formare durante il processo di perossidazione lipidica in cui sono presenti dei radicali perossilici intermedi che reagendo fra di loro formano un tetrossido che, decomponendosi produce ossigeno singoletto oltre a un composto carbonilico e ad un alcool o ad un perossido

L’ossigeno singoletto viene inoltre prodotto durante la reazione fra lo ione ipoclorito e l’acqua ossigenata attraverso l’enzima mieloperossidasi.
Azione fotodinamica
Nei casi finora sopra indicati la formazione dell’ossigeno singoletto avviene indipendentemente dalla luce, ma c’è un’altra possibilità di formazione dell’ossigeno singoletto estremamente importante per le implicazioni che può avere sul piano fisiologico e patologico e che viene a dipendere dalla cosidetta azione fotodinamica . Questa interazione si basa sul fatto che gli organismi viventi , in presenza di luce, raggi UV, e di particolari sostanze di origine esogene o endogena chiamate fotosensibilizzatori ,subiscono tutta una serie di danni ossidativi che possono risultare letali. Di questi foto sensibilizzatori i più noti sono la riboflavina, la clorofilla, l’eritrosina, alcuni coloranti , idrocarburi aromatici ecc.
La maggior parte di questi composti assorbe nel visibile o nel vicino ultravioletto secondo la reazione :
3fotosens—-hv——-1fotosens–ossigeno singoletto
Ciò comporta che una volta formatosi , l’ossigeno singoletto è in grado di reagire con parecchie classi di composti, molte delle quali sono di interesse biologico. Ad esempio, può attaccare i doppi legami dei caroteni, delle clorofille e degli acidi grassi insaturi mediante reazioni di addizione con formazione di idroperossidi o endoperossidi che vanno poi incontro ad ulteriori stadi di degradazione. E’ anche in grado di ossidare le basi puriniche e pirimidiniche provocando danni anche al DNA e danneggiare le proteine ossidando nella sua azione distruttrice soprattutto i residui di metionina, triptofano, istidina e cisteina.
L’ossigeno singoletto può legarsi anche ai doppi legami degli acidi grassi portando alla formazione degli idroperossidi i quali si scindono in radicali liberi, promotori della reazione di autossidazione
I disattivatori dell’ossigeno singoletto
Il problema dell’ossigeno singoletto è molto importante nei vegetali fotosintetici che contengono clorofilla che è un fotosensibilizzatore estremamente efficiente . I carotenoidi presenti nei vegetali interagiscono efficacemente con l’ossigeno singoletto e sono in grado di disattivare il trasferimento dell’eccitazione all’ossigeno atmosferico praticamente senza venir modificati nella loro struttura chimica e ad una velocità estremamente elevata.
Attualmente, esistono oltre 600 tipi di carotenoidi conosciuti, e nonostante la loro composizione chimica sia simile, posseggono nomi assai diversi, correlati alla fonte biologica da cui sono stati isolati per la prima volta, dalla quale richiamano la denominazione botanica (carotene da Daucus carota la carota per intenderci, licopene da Lycopersicum esculentum nei pomodori, zeaxantina da Zea mays nel mais ecc.ecc.). Il β-carotene è il tipo predominante nella maggior parte delle foglie verdi, e tanto più elevata è la sua concentrazione, tanto più intensa appare la colorazione delle parti che lo contengono.
Essi possono essere semplici catene idrocarburiche come i caroteni (licopene, β-carotene) o includere gruppi funzionali ossigenati, come le xantofille (astaxantina, luteina). Come molti antiossidanti, i carotenoidi, esercitano la loro attività antiossidante attraverso diversi ma molto complementari meccanismi di azione, per esempio agendo da “inattivatori di radicali liberi” o per l’appunto da disattivatori dell’ossigeno singoletto 1O2.
Quest’ultimo meccanismo di azione, prevede l’estinzione dell’ossigeno singoletto 1O2 , nell’ ossigeno molecolare O2.
1O2 + β-carotene → O2 + β-carotene●
L’eccesso di energia generata nello stato eccitato della molecola (β-carotene●), viene dissipata attraverso interazioni con il solvente o con l’ambiente in cui opera.
β-carotene● → β-carotene + calore
Il beta-Carotene
Il rigenerato β-carotene, attraverso questo meccanismo di dissipazione dell’energia, può così ricominciare un nuovo ciclo di disattivazione dell’ossigeno singoletto. È assodato che i carotenoidi possono estinguere circa 1000 molecole di 1O2, prima di incorrere in reazioni di degradazione.
Infine, oltre ai carotenoidi anche i tocoferoli e i tioli possono agire da “1O2 quenchers”, contribuendo a proteggere i sistemi biologici dai danni ossidativi
Conclusioni
Quando ci esponiamo al sole, proteggiamo sempre la nostra pelle con un buon prodotto solare che abbia sia un fattore di protezione adeguato al nostro fototipo ma che in più che contenga principi attivi dalle proprietà antiossidanti in grado di disattivare l’ossigeno singoletto . Il Beta carotene presente nell’olio di carota è un esempio di come proteggere in modo sicuro la pelle durante l’esposizione al sole.
Autore: Porto Pietro
Bibliografia
-A.Bindoli, L.Cavallini “I Radicali liberi , aspetti biochimici e medici” – Piccin editore
-Peter Pugliese, Zoe Draelod “Physiology of the skin” third edition – Alluredbooks 2011
-M.Laguerre et al., 2007
